
吸蜜鸚鸝之鸚鵡喙羽病病毒與多瘤病毒混合感染症
蔡向榮 李照陽 許志明 林靜怡 陳榕思 共同編著
國立台灣大學獸醫學系暨獸醫學研究所台北市
凡賽爾賽鴿寵物鳥醫院台北市
( 收稿日期: 94 年9 月5 日。接受日期: 9 4 年1 0 月3 1 日)
摘要
某飼主新購入之2 8 至3 5 日齡吸蜜鸚鵡雛鳥陸續出現悼羽、厭食、下病和焦躁不安的情形, 死亡率高達7 0 . 6 % ( 1 2/1 7 ) ﹒ 存活的鸚鸝有生長遲緩、羽毛不全、焦燥不安的情形﹒ 經採取三隻較嚴重之鸚鵡剖檢,並未發現有特異性病變﹒但組織病理學檢查在心肌與毛囊細胞發現核內包涵懂,臟器檢體經分別以二對偵測鳥多宿病毒( a vi a n polyomavirus, A PV ) 之VP 1 或tIT 抗原基因的引子, 及對偵測鸚鵡喙羽病病毒( psittacinebeak and feather disease virus; P B F DV ) 之O R F V 1 基因的引子進行聚合臨鏈反應(P C R ) ﹒ 此三隻鸚鵲以三對引子檢測結果均呈陽性反應, PCR 產物經定序後與基因庫內之序列比對﹒ 分別證實為APV 及PBFDV 。本文為台灣首次在非鸚哥類鸚鵡的A PV與P B FDV混合感染病例報告﹒ [ 蔡向榮、李照陽、許志明、林靜怡、陳榕思。]吸蜜鸚鵡之鸚鵡喙羽病病毒與多瘤病毒混合感祟症。台灣獸醫誌3 2 (1 ) : 5 6 -日· 2 0 06 。連絡人TEL : 02-23692844 • FAX: 02-2364 9154 • E-mail:“aihj@ntu.edu.tw]
關鍵字 鸚鵡喙羽病毒, 多瘤病毒, 吸蜜鸚鵡, 聚合脢鏈鎖反應
緒言
鳥多瘤病毒(avian polyomavirus; APV),屬於Family Papovaviridae,Genus Polyomavirus,為無被膜的環狀雙股DNA病毒,大小約40-55 nm。APV主要在鸚哥的雛鳥(budgerigar neonates)造成急性全身性的症狀,又稱小鸚哥病(budgerigar fledgling disease;BFD),但由於所有的年齡的鸚鵡科鳥類皆可被感染,因此現在常用APV感染症的病名取代BFD [27]。
APV感染症之臨床症狀的表現和鸚哥(budgerigars)的年齡有關。10-15日齡的小鸚哥可能在尚未出現臨床症狀前就急性猝死,未發生猝死的小鸚哥則會有臨床症狀的出現,包括明顯的對稱性掉羽、腹部腫大、皮膚變色、皮下出血,有時還會出現神經症狀,如頭頸的震顫、共濟失調。本病的死亡率和感染年齡相關,未成年之小鸚哥在臨床症狀出現後通常都會迅速死亡,耐過的鳥隻於隔年之換羽季節會再長出羽毛[2, 5, 27]。非鸚哥類的鸚鵡(non-budgerigar psittacine birds)之APV感染症,其常常為不顯性感染。超急性感染之雛鳥可能猝死,而急性感染的臨床症狀包括精神沉鬱、厭食、體重、嗉囊排空延遲、食物逆流、共濟失調、癱瘓、皮下出血、呼吸困難。患病鳥隻極易出血,肌肉注射或是羽毛被拔出都會大量出血。慢性感染的臨床症狀包括體重下降、間歇性厭食、多尿、羽毛發育不全以及二次性感染等。非鸚哥類的鸚鵡之APV感染症,其羽毛病變不如鸚哥嚴重。疾病發生時,通常超急性、急性及慢性感染都會。非鸚哥類的鸚鵡之APV感染症,在高風險之雛鳥死亡率在27-41%之間[8, 13, 27]。
鸚鵡喙羽病病毒(psittacine beak and feather disease virus; PBFDV),屬於Family Circoviridae,Genus Circovirus,為無被膜的環狀單股DNA病毒,大小約14-26 nm [29]。PBFDV可感染鸚鵡科鳥類,臨床症狀包括體重減輕、羽毛發育不良、脫毛及喙部會有畸型情況,及會損害免疫組織器官並會抑制免疫系統。急性感染大多發生在三歲以下之鳥禽,在第一次長羽時期(28-32日齡),鳥類會有沉鬱及脫羽情形,並會造成敗血症性肺炎及腸炎,嚴重時會致死,但大多數死亡病例多為二次性感染造成,慢性感染則在換羽後發生,以慢性漸進性、對稱性的羽毛生長不良和偶見的嘴喙病變,故稱鸚鵡喙羽病(psittacine beak and feather disease;PBFD)[3,4,20,21]。
APV感染症目前已知在美國 [25]、加拿大 [2]、日本 [10] 、非洲 [7]、澳洲[20,21,22]以及歐洲中部 [32]皆有病例報告。在台灣,於1987年有小鸚哥 (budgerigar)之感染病例報告[1],至於非鸚哥之鸚鵡類(non-budgerigar psittacine birds)則尚未見有病例報告。鸚鵡喙羽病 (PBFD)最初只在澳洲的野生鸚鵡發現[20,21],但隨著鳥類的世界貿易已傳播至世界各地,包括英國、德國、葡萄牙、美國、西班牙、沙烏地阿拉伯、以色列、印度、日本、波多黎克、紐西蘭 [6] 、辛巴威[17] 與南非[9] 等地皆有報告,惟在台灣尚未見有報告。
本文即報告一個在屬於非鸚哥之鸚鵡類(nonbudgerigar psittacine birds)-吸蜜鸚鵡發生之鳥多瘤病毒(APV)與鸚鵡喙羽病病毒(PBFDV)之混合感染病例。
病歷
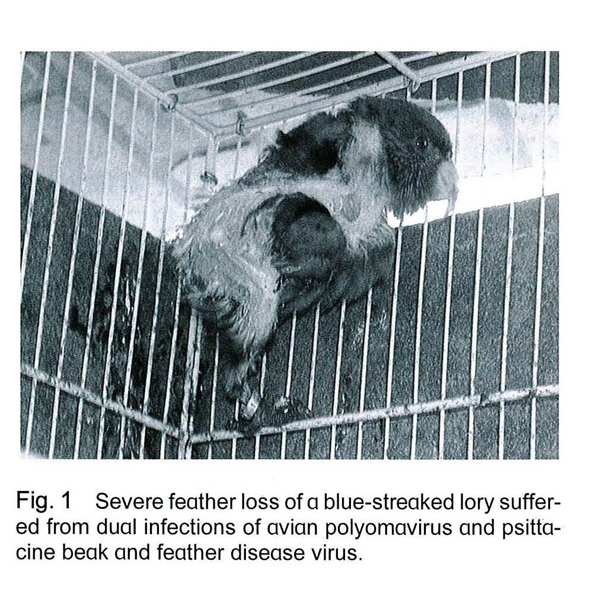
2002年5月,桃園某飼主由屏東購進17隻吸蜜鸚鵡雛鳥,約為28至35日齡,以一般商業化的飼料餵食,這些雛鳥並未曾接種任何疫苗。6月,鳥隻開始出現掉羽、厭食、下痢和焦躁不安的情形,並且陸續有12隻(70.6%)死亡。存活的五隻鳥(包括四隻藍紋吸蜜鸚鵡[Blue-streaked Lory; Eos reticulata]與一隻史旺森氏吸蜜鸚鵡[Swainson’s Lorikeet; Trichoglosus haematodus moluccanus])有生長遲緩、羽毛不全、並有性情焦燥不安互相攻擊的情形。飼主於9月送檢,臨床檢查可發現鳥隻的背側及雙側翼羽嚴重脫落的情形 (Fig. 1)。於五隻吸蜜鸚鵡中選出三隻臨床症狀較嚴重者,經安樂死後,進行病理學與分子生物學檢查,此三隻皆為雄性。
細菌學檢查
自肝、腎、脾、肺、心等臟器採樣以tryptic soy agar (TSA)及MacConkey agar培養基於37℃培養,48小時後皆未觀察到任何細菌生長。
黴菌學檢查
分別進行羽毛毛根之鏡檢及羽囊切片之periodic acid schiff (PAS)特殊染色,兩者結果皆為陰性,均未發現任何黴菌菌絲。
病理學檢查
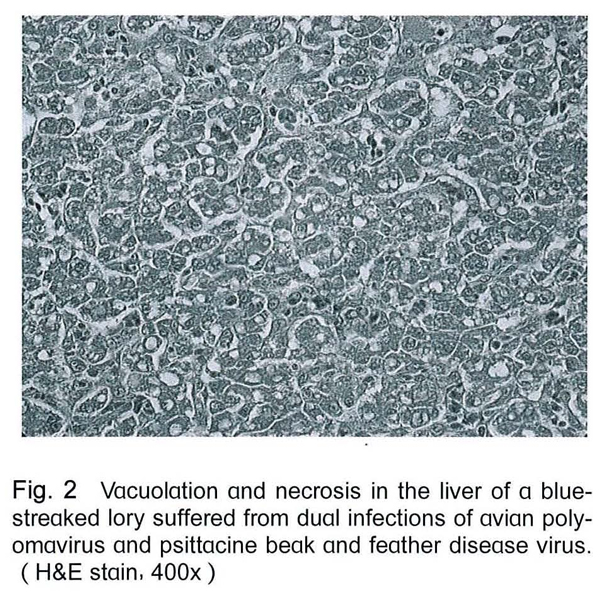
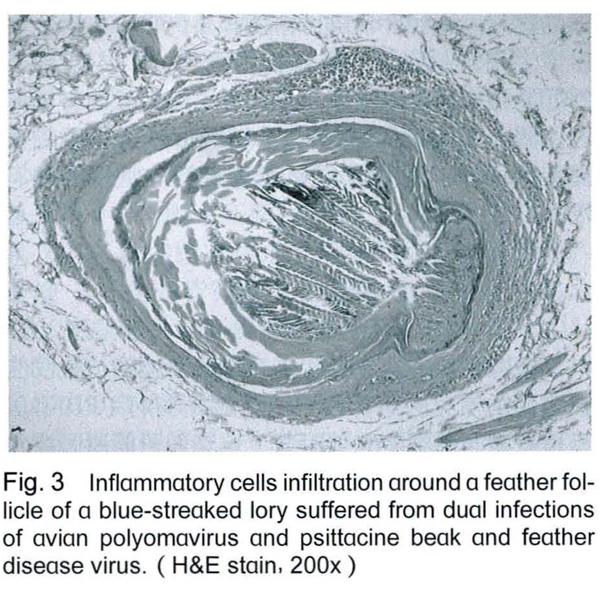
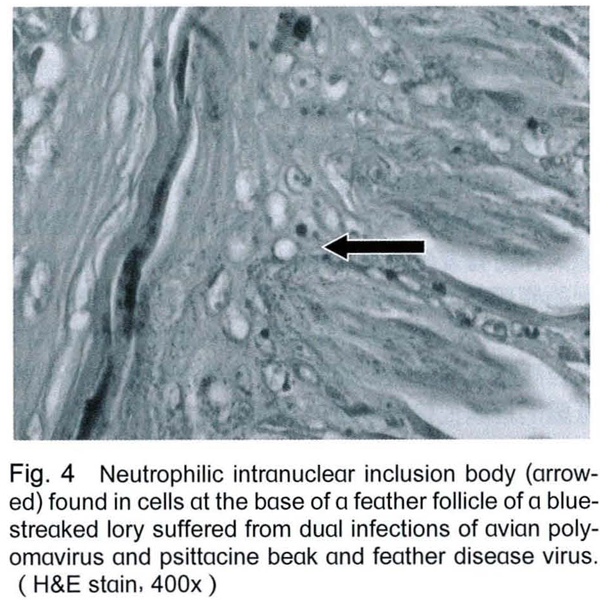
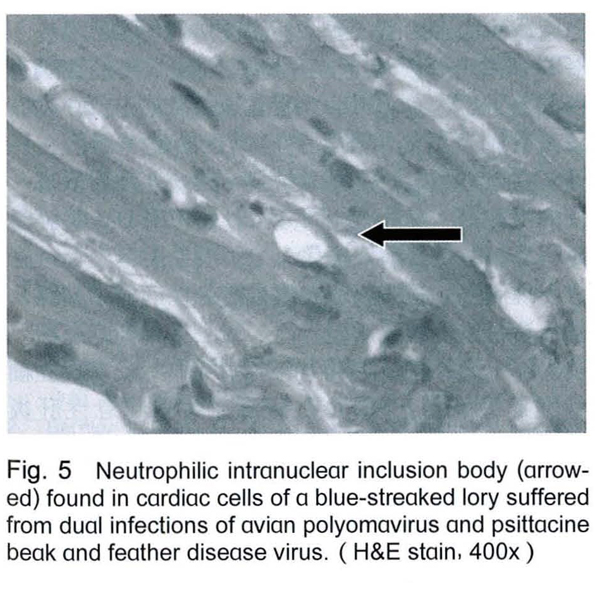
剖檢後除1隻吸蜜鸚鵡肝臟表面可見有黃白色斑塊外,並無其他肉眼病變。組織病理檢查可見肝臟細胞有空泡化及壞死的情形 (Fig. 2),脾臟漿膜處有炎症細胞浸潤,羽囊周圍有炎症細胞浸潤 (Fig. 3),且於羽囊底部之細胞 (Fig. 4)與心肌細胞 (Fig. 5)發現嗜中性核內包涵體,細胞核並被擠壓至一旁。
病材乳劑製作
將三隻病情較嚴重隻鳥隻安樂死後,採取心、肝、肺、腎、腦、脾、華氏囊及糞便等製成乳劑,其方法如下:將病材剪切成小塊放置乳缽內,加入滅菌玻璃粉後以乳棒磨碎,再加入2mL 0.1 x TE buffer (10 mM Tris-HCl, 1 mM EDTA),經 -20℃冷凍解凍三次,再經 1,000 x g,離心5分鐘,取上清液保存於-20 ℃備用。
電子顯微鏡學檢查
病材乳劑以氣動式離心機超高速離心10分鐘,取沉澱物以2%磷鎢酸鉀行負染色,在穿透式電子顯微鏡(日立)下觀察,並未觀察到病毒顆粒之存在。
聚合酶連鎖反應(Polymerase chain reaction;PCR)
Avian polyomavirus (APV)之檢測共使用兩組引子,第一組PCR方法依Phalen等[23]所述之方法實施,使用APV引子1 序列為5’-CAAGCATATGTCCCTTTATCCC -3’, APV引子2 序列為 5’-CTGTTTAAGGCCTTCCAAGATG -3’,APV引子1、2係用以偵測病毒的VP1 protein coding region,預期產物長度為約550 bp。 第二組PCR係依Johne 及Muller [14] 所述之方法實施,使用之APV 引子A序列為5’-CTTATGTGGGAGGCTGCAGTGTT-3’, APV引子B序列為 5’-TACTGAAATAGCGTGGTAGGCCTC -3’, APV引子A、B係用以偵測病毒的t/T antigen coding region,預期產物長度則約310 bp。
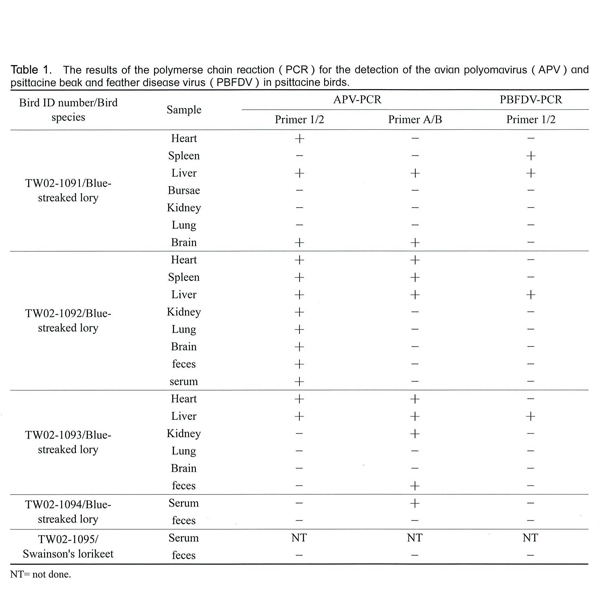
二組PCR檢測結果如Table 1,三隻鸚鵡皆呈APV陽性反應,呈現陽性反應的臟器包括心、肝、肺、腎、腦、脾,但以心及肝的檢出率最高 ,二隻未犧牲之鸚鵡的糞便檢體皆為陰性,但其中一隻有採血清檢體的則在APV引子AB之檢測結果呈陽性反應。
鸚鵡喙羽病病毒(psittacine beak and feather disease virus;PBFDV)之檢測係依Ypelaar等[33]所述之方法實施,使用之PCV引子1與2之序列分別為5’-AACCCTACAGACGGCGAG-3’與5’-GTCACAGTCCTCCTTGTACC-3’。 PBFDV引子1、2係用以偵測PBFDV的open reading frame V1 (ORF V1),預期產物長度則約717 bp。
PCR檢測結果三隻鸚鵡皆呈PBFDV陽性反應,呈現陽性反應的臟器包括脾及肝,並以肝的檢出率最高。二隻未犧牲之鸚鵡的糞便與血清檢體則皆為陰性(Table 1)。
DNA 序列分析
將部分PCR產物以gel extraction system (Gel-MTM, Viogene-Biotek Corp., France)進行純化,純化之PCR產物以核酸自動定序儀(ABI337 PE , Applied Biosystem, CA)定序。定序結果經雙向判讀、互相比對後,以DNASTAR軟體 (Madison, WC) MegAlign program中之Clustal W 方法排列並與基因庫中APV及PBFDV序列比對,計算相似及相異百分比及親源樹狀圖(phylogentic tree)之分析。
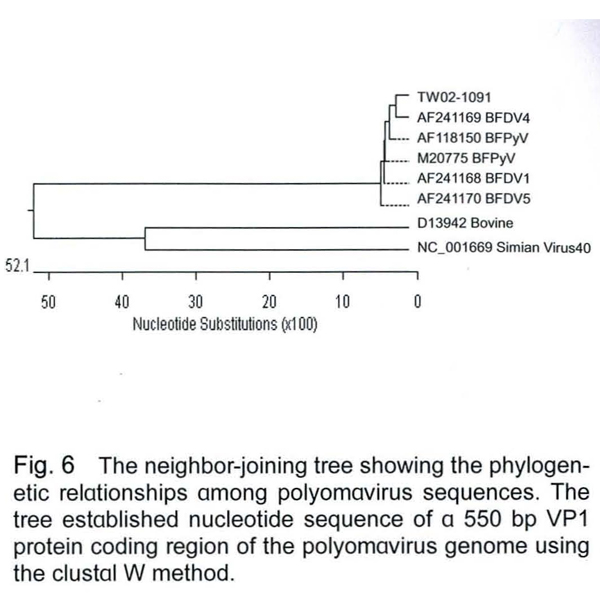
將TW02-1091株的APV primer 1、2的產物序列和基因資料庫(GenBank) 的序列比對之後,和國外發表之APV序列(AF118150、AF118168、AF118169、AF118170、M20775 ) 有96.6-97.3%的相似度,而與牛的polyomavirus (D13942)及猿猴的simian virus 40 (NC_001669) 的相似度則分別只有10.7%與7.3%(資料未附),而在親源樹狀圖分析可以明顯的發現,TW02-1091之APV primer 1、2的PCR產物序列和其它APV均屬同一群,而與牛的polyomavirus及猿猴的simian virus 40有極大的差異(Fig. 6),序列分析的結果可以確認本病例鸚鵡有APV的感染。
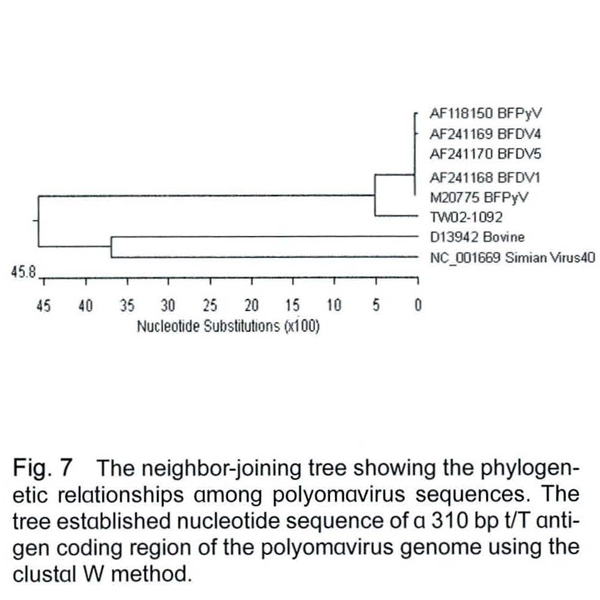
將TW02-1092株的APV primer A、B的產物和基因資料庫的序列比對後,和國外發表之APV序列(AF118150、AF118168、AF118169、AF118170、M20775) 有高達97.4-98.5%的相似度,而與牛的polyomavirus (D13942)及猿猴的simian virus 40 (NC_001669) 的相似度則分別只有48.8%與47.3%(資料未附),在親源樹狀圖分析可以明顯的發現,TW02-1091之APV primer 1、2的PCR產物序列和其它APV均屬同一群,而與牛的polyomavirus及猿猴的simian virus 40有極大的差異(Fig. 7),序列分析的結果可以再度確認本病例鸚鵡有APV的感染。
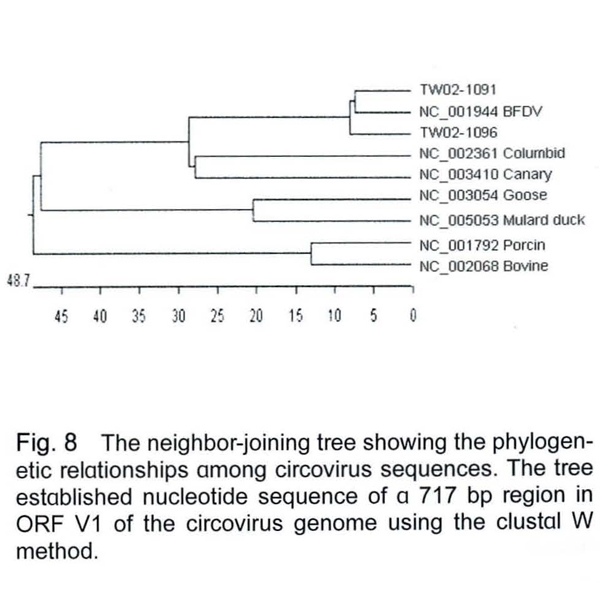
TW02-1091株與TW02-1096株的PBFDV primer 1、2的產物基因序列相似度達99.9%,與此兩個序列與基因資料庫的PBFDV序列(NC_001944)比對所得相似度為91.5-93.8%,但與鴿子(NC_002361) 、金絲雀(NC_003410)、鵝(NC_003054)、綠頭鴨(Mallard duck) (NC_005053) 、豬(NC_001792)、牛(NC_002068 )等動物之circovirus則只有26.8-66.8%之相似度(資料未附),在親源樹狀圖分析中發現,PBFD的PCR產物序列和其他PBFDV佔有相同之位置,而與其他的動物之circovirus有極大的差異(Fig. 8),序列分析的結果確認本病例鸚鵡有PBFDV的感染。
討 論
根據鳥隻的臨床症狀,在鸚鵡可能造成脫羽的原因包括常見的病毒性疾病鸚鵡喙羽病(PBFD)及鳥多瘤病毒感染症(BFD),其他可能原因還包括營養不良、細菌感染、黴菌感染等。對於本病例,經由細菌學及黴菌學檢測結果均為陰性,因此排除其為病因。另外,剖檢未見到有營養不良症狀,且畜主過去所餵食為均衡之人工飼料,所以亦排除營養不良的可能性。
進一步經由以兩對分別針對APV之VP1與t/T抗原基因之引子進行PCR的檢測結果,所有鸚鵡在多種臟器皆呈現APV陽性,PCR產物序列分析的結果可以確認本病例鸚鵡有APV的感染。非鸚哥鸚鵡類感染APV時,肉眼病變通常包括肝臟腫大伴隨有多發性的黃色病灶、脾臟腫大、蒼白腫大的腎臟、蒼白的心肌及骨骼肌、羽毛萎縮、腹水、皮下出血及小腸和心臟出血。典型之嗜中性核內包涵體不一定能被觀察到,一般較常見於脾臟及肝臟,但其他臟器組織亦有可能[8,13,27]。本病例雖於羽囊、肝臟及脾臟見到組織病變,並於心、肝、肺、腎、腦、脾皆可檢測到APV核酸,但以心及肝的檢出率最,但僅於心肌及羽囊觀察到典型的APV空泡樣核內包涵體。
本病例雖未見PBFD典型的巨大質內包涵體,但五隻鳥中至少有三隻PCR檢測為PBFDV陽性,PCR產物序列分析的結果可以確認本病例鸚鵡有PBFDV的感染。PBFDV感染鳥禽後首先會在黏液囊和胃腸區域的淋巴組織中進行複製,而後在肝臟,胸腺和其他的組織中複製。最後,攻擊表皮,使羽毛脫落,露出皮膚組織 [11]。PBFDV感染鸚鵡科鳥類的肉眼病理變化大多為羽毛脫落及免疫器官出現病變。組織病理上可見在急性病例中胸腺及華氏囊可出現壞死病變 [12]。羽毛上皮細胞有壞死及水腫,造成生長中羽毛的羽鞘增厚,及有炎症細胞聚集等病變。PBFDV病毒並會引起急性肝炎[15,19]。 PBFDV病毒可引起細胞核內或細胞質內包涵體,但以細胞質內包涵體較常見,尤其是在疾病早期,包括皮膚、羽毛、羽囊、肝臟、腸道、脾臟、胸腺及華氏囊等臟器組織皆有發現包涵體之報告 [12,18,19]。本病例僅在發現肝臟細胞有空泡化及壞死病變,並在脾臟漿膜與羽囊周圍發現炎症細胞浸潤,且僅在脾臟及肝臟皆能檢出PBFDV之DNA,但並未發現細胞質內包涵體。本病例皆為雛鳥在6-9月齡,三個月間死亡12隻,死亡率高達70%,經追蹤存活未予犧牲的兩隻吸蜜鸚鵡於送檢一年內亦皆死亡,由於非鸚哥類的鸚鵡之APV感染症,在高風險之雛鳥死亡率在27%-41%之間[27],本病例死亡率甚高,可能與PBFDV共同感染以致免疫力下降有關[31,33]。由於這些雛鳥並未曾接種任何疫苗,並且鸚鵡喙羽病尚無任何市售疫苗,而APV亦只有不活化疫苗[28],因此可以排除本病例檢測到的兩種病因為疫苗毒的可能性。本病例雖經由臨床檢查、病理學檢查與分子生物學檢查之結果診斷為鳥多瘤病毒(APV)與鸚鵡喙羽病病毒(PBFDV)之混合感染,惟由於本病例之主徵爲羽毛不全,如能進一步再以核酸探針檢測毛囊,則將更能確認病因與疾病之關係。
APV與PBFDV皆可垂直傳染及水平傳染。水平傳染係經由羽毛、皮屑和糞便排毒,再經由口腔或呼吸道感染。垂直感染方面則是藉由親代鳥在感染後之病毒血症時期感染或在反芻餵食雛鳥時,將帶有病毒的消化上皮細胞一起餵食給雛鳥而造成感染 [3,16,26,30]。本病例畜主所購入之17隻吸蜜鸚鵡雛鳥全數感染發病,顯示APV與PBFDV的高傳染能力。當鳥舍不幸爆發感染時,應立即停止一切繁殖行為。如此,一方面可以減少成鳥之緊迫而有時間休息以產生免疫力;另一方面也能避免產生不健康之雛鳥。所有倖存之雛鳥都應該被淘汰,而成鳥也應休息六個月,因為有研究顯示APV血清學檢驗呈陽性的有交配經驗的成鳥經過七個月以上之休息後,再次交配時所產的雛鳥之血清學檢驗為陰性[24]。 目前國外已有APV不活化疫苗[28],國內尚未引進之前,良好衛生管理配合避免購入感染鳥隻、封閉式鳥舍管理、衛生消毒、避免外賓來訪等生物安全防護措施應是最佳之預防方法。
參 考 文 獻
1. 蔡信雄。自然及人工感染小鸚哥病之病理學研究。台畜獸醫會報 50: 1-14, 1987。
2. Bernier G, Morin M, Marsolais G. A generalized inclusion body disease in the budgerigar (Melopsittacus undulatus) caused by a papovavirus-like agent. Avian Dis 25: 1083-1092, 1981.
3. Cooper JE, Gschmeissner S, Parsons AJ, Coles BH. Psittacine beak and feather disease. Vet Rec 120: 287, 1987.
4. Crawford GR. Circoviridae: new viruses of pigs, parrots and chickens. Aust Vet J 71: 351, 1994.
5. Davis RB, Bozeman LH, Gaudry D, Fletcher OJ, Lukert PD, Dykstra MJ. A viral disease of fledgling budgerigars. Avian Dis 25: 179-183, 1981.
6. De Kloet E, de Kloet SR. Analysis of the beak and feather disease viral genome indicates the existence of several genotypes which have a complex psittacine host specificity. Arch Virol 149: 2393-2412, 2004.
7. Enders F, Gravendyck M, Gerlach H, Kaleta EF. Fatal avian polyomavirus infection during quarantine in adult wild-caught red-faced lovebirds (Agapornis pullaria). Avian Dis 41: 496-498, 1997.
8. Graham DL, Calnek BW. Papovavirus infection in hand-fed parrots: virus isolation and pathology. Avian Dis 31: 398-410, 1986.
9. Heath L, Martin DP, Warburton L, Perrin M, Horsfield W, Kingsley C, Rybicki EP, Williamson AL. Evidence of unique genotypes of beak and feather disease virus in Southern Africa. J Virol 78: 9277-9284, 2004.
10. Hirai K, Nonaka H, Fukushi H, Shimakura S, Masegi T. Isolation of a papova-like agent from young budgerigars with feather abnormalities. Jpn J Vet Sci 46:577-582, 1984.
11. Ignjatovic J. Circoviridae: new viruses of pigs, parrots and chickens. Aust Vet J 72: 40, 1995.
12. Jacobson ER, Clubb S, Simpson C, Walsh M, Lothrop CD, Jr, Gaskin J, Bauer J, Hines S, Kollias GV, Poulos P. Feather and beak dystrophy and necrosis in cockatoos: clinicopathologic evaluations. J Am Vet Med Assoc 189: 999-1005, 1986.
13. Jacobson ER, Hines SA, Quesenberry K, Mladinich C, Davis RB, Kollias GV, Olsen J. Epornitic of papova like virus associated disease in a psittacine nursery. J Am Vet Med Assoc 185: 1337-1341, 1984.
14. Johne R, Muller H. Avian polyomavirus in wild birds: genome analysis of isolates from Falconiformes and Psittaciformes. Arch Virol 143: 1501-1512, 1998.
15. Kiatipattanasakul-Banlunara W, Tantileartcharoen R, Katayama K, Suzuki K, Lekdumrogsak T, Nakayama H, Doi K. Psittacine beak and feather disease in three captive sulphur-crested cockatoos (Cacatua galerita) in Thailand. J Vet Med Sci 64: 527-529, 2002.
16. Kingston RS. Budgerigar fledgling disease (papovavirus) in pet birds. J Vet Diagn Invest 4, 455-458, 1992.
17. Kock ND, Hangartner PU, Lucke V. Variation in clinical disease and species susceptibility to psittacine beak and feather disease in Zimbabwean lovebirds (Onderstepoort) J Vet Res 60: 159-161, 1993.
18. Latimer KS, Rakich PM, Kircher IM, Ritchie BW, Niagro FD, Steffens WL 3rd, Lukert PD. Extracutaneous viral inclusions in psittacine beak and feather disease. J Vet Diag Invest 2: 204-207, 1990.
19. Latimer KS, Rakich PM, Steffens WL, Kircher IM, Ritchie BW, Niagro FD, Lukert PD. A novel DNA virus associated with feather inclusions in psittacine beak and feather disease. Vet Pathol 28: 300-304, 1991.
20. McOrist S, Black DG, Pass DA, Scott PC, Marshall J. Beak and feather dystrophy in wild sulphur-crested cockatoos (Cacatua galerita). J Wildl Dis 20: 120-124, 1984.
21. Pass DA, Perry RA. The pathology of psittacine beak and feather disease. Aust Vet J 61: 69-74, 1984.
22. Pass DA, Prus SE, Riddell C. A papova-like virus infection of splendid parakeets (Neophema splendida). Avian Dis 31: 680-684, 1987.
23. Phalen DN, Wilson VG, Graham DL. Polymersae chain reaction assay for
avian polyomavirus. J Clin Microbio 29: 1030-1037, 1991.
24. Phalen DN, Wilson VG, Graham DL. Production of avian polyomavirus seronegative budgerigars (Melopittacus undulates) from seropositive adults. Avian Dis 39:897-899, 1995.
25. Phalen DN, Wilson VG, Graham DL. Characterization of the avian polyomavirus-associated glomerulopathy of nestling parrots. Avian Dis 40: 140-149, 1996.
26. Raidal S, Sabine M, Cross GM Laboratory diagnosis of psittacine beak and feather diseases by hemagglutination and hemagglutination inhibition. Aust Vet J 70: 133-137, 1993.
27. Ritchie BW. Avian viruses: function and control. Lake Worth, Fla, P.136-171, 1995.
28. Ritchie BW, Latimer KS, Leonard J, Pesti D, Campagnoli R, Lukert PD. Safety, immunogenicity, and efficacy of an inactivated avian polyomavirus vaccine. Am J Vet Res 59:143-148, 1998.
29. Ritchie BW, Niagro FD, Lukert PD, Steffens WL 3rd, Latimer KS. Characterization of a new virus from cockatoos with psittacine beak and feather disease. Virology 171: 83-88, 1989.
30. Ritchie BW, Niagro FD, Latimer KS, Steffens WL, Pesti D, Ancona J, Lukert PD. Routes and prevalence of shedding of psittacine beak and feather disease virus. Am J Vet Res 52: 1804-1809, 1991.
31. Schoemaker NJ, Dorrestin GM, Latimer KS, Lumji JT, Klik MJL, van der Hage MH, Campagnoli RP. Severe leukopenia and liver necrosis in young African grey parrots (Psittacus erithacus erithacus) infected with psittacine circovirus. Avian Dis 44: 470-478, 2000.
32. Stoll R, Luo D, Kouwenhoven B, Hobom G, Muller H. Molecular and biological characteristics of avian polyomaviruses: isolates from different species of birds indicate that avian polyomaviruses form a distinct subgenus within the polyomavirus genus. J Gen Virol 74 (Pt 2): 229-237, 1993.
33. Ypelaar I, Bassami MR, Wilcox GE, Raidal SR. A universal polymerase chain reaction for the detection of psittacine beak and feather disease virus. Vet Microbiol 68: 141-148, 1999.
A concurrent outbreak of psittacine beak and feather disease virus and avian polyomavirus infection in lorries (Eos reticulata) and lorikeets (Trichoglosus haematodus moluccanus)
Hsiang-Jung TSAI, Chio-Yang LEE, Chih-Ming HSU, Chin-I LIN and Non-Sie CHEN
Department and Graduate Institute of Veterinary Medicine, National Taiwan Univeisity, Taipei 106, Taiwan
VERSELE-LAGA Pigeon and Pet Bird Hospital, Taipei 103, Taiwan
ABSTRACT A dual natural infection with psittacine beak and feather disease virus (PBFDV) and avian polyomavirus (APV) in lories and lorikeets was described. All the newly purchased 28-35 day-old birds in an aviary were affected and mortality was high (12/17, 70.6%). The clinical signs included feather loss, anorexia, diarrhea and listlessness. Surviving birds showed growth retardation, feather loss and listlessness. Necropsies of birds demonstrated non-specific gross lesions, but intranuclear inclusions were found in the cells of feather follicles and cardiac muscles in histological findings. Two sets of primers were used to detect VP1 and t/T antigen coding regions of APV, respectively. Another set of primer for the amplification of the ORF V1 region of the PBFDV was used. All the three birds tested were PCR positive by three sets of primers. Sequencing of the PCR product and sequence comparisons with other related viruses confirmed their classification as APV and PBFDV, respectively. This is the first description of a concurrent outbreak of PBFDV and APV infection in non-budgerigar psittacine birds in Taiwan. [*Tsai HJ, Lee CY, Hsu CM, Lin CI and Chen NS.A concurrent outbreak of psittacine beak and feather disease virus, and avian polyomavirus infection in lorries (Eos reticulata) and lorikeets (Trichoglosus haematodus moluccanus). Taiwan Vet J XX (X): XX-XX, 2005。*Corresponding author TEL: 02-2369-2844‚FAX: 02-2364-9154‚E-mail: tsaihj@ntu.edu.tw]
Key words: Avian polyomavirus (APV), Lorikeet, Lory, Polymerase chain reaction (PCR), Psittacine beak and feather disease virus (PBFDV)